|
LECON N° |
Devoir : Ÿ Remédiation : Ÿ |
Nom :………… |
Classe : Groupe : |
|
|
Date :…………… |
Rattrapage : Ÿ
Soutien : Ÿ |
Prénom :………… |
Note contrôle : |
Note
évaluation : |
CORRIGE du devoir N°2 sur
l’atome 1
I) CONTROLE:
La matière est formée de très petites particules appelées
« atomes » ; Décrire un atome et donner les noms de ses
principaux constituants :
L’élément carbone se
note ![]()
Quel est le numéro atomique de l’atome de
carbone ?
A quoi correspondent les deux nombres 6 et 12 ?
Dessiner schématiquement l’atome d’oxygène ![]()
Qu’est qu’une mole d’atomes ?
Qu ‘ appelle - t- on « nombre d’ Avogadro » ,
donnez sa valeur ?
Dans la formule du sel ( chlorure
de sodium) on a du Na+ et du
Cl - . A quoi correspondent
les écritures Na+ et Cl - ?
Comment s’exprime la masse molaire d’un atome ?
Qu’appelle - t on : masse molaire
atomique ?
Que représente « aussi » le « nombre de
masse » ?
.
Quelle est la masse molaire ?:
de
l’oxygène :
de
l’hydrogène :
, du carbone :
, de l’azote :
, du chlore :
Que donne comme information le nombre d’
Avogadro ?
.
Répartition des électrons
( remplissage des couches) :
Les différentes
couches sont caractérisées par un nombre « n » appelé
« nombre quantique ». Chacune peut recevoir au maximum
« 2n² »électrons.
1°) Calculer les nombres d’électrons que peuvent recevoir la
couche « K » pour laquelle « n = 1 », la couche L pour
laquelle n = 2 et la couche M pour laquelle n= 3.
2°) Les électrons remplissant les couches successives dans
l’ordre ci dessus ( n croissant) , déterminer leur
répartition dans le cas de l’atome de soufre ![]()
|
Couche |
« n » |
Nombre d’électrons |
|
K |
|
|
|
L |
|
|
|
M |
|
|
3°) Comparer les nombres d’électrons dans la dernière couche
occupée par le fluor ( Z = 9 ) et pour le chlore ( Z = 17).
II )EVALUATION:
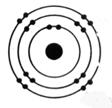
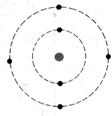
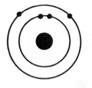
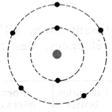
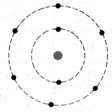
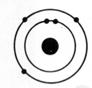
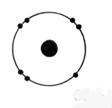
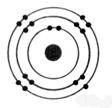
1°) Trouver, à
partir des symboles les nombres d’électrons, de protons et de neutrons contenu
dans l’ atome et en faire le modèle de Bohr:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Idem : |
Donner les mêmes informations que ci dessus .Que constatez
vous ? ( ne pas faire le modèle de Bohr). |
|
|
|
|
|
|
|
|
Quelle est la structure électronique des éléments suivants :?
|
Si ( Z = 14) |
« Z » = 14 protons |
|
|
S ( Z = 16) |
|
|
|
Ar ( Z = 18) |
|
|
|
Be ( Z = 4) |
|
|
En vous aidant du tableau de
classification identifier et nommer
chaque élément :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|