|
LECON N°1 CHIMIE |
Devoir : Ÿ Remédiation : Ÿ |
Nom :………… |
Classe : Groupe : |
|
|
Date :…………… |
Rattrapage : Ÿ
Soutien : Ÿ |
Prénom :………… |
Note contrôle : |
Note
évaluation : |
CORRIGE du devoir
N°1 sur l’atome ;
I) CONTROLE:
Voir le tableau de classification des éléments !!!!
1°) Compléter la phrase : Un corps
simple n’est constitué que d’un élément……………………………
2°) Compléter la phrase : Un corps composé contient ……au moins deux éléments………………………….
3°) Combien recense t – on d’éléments
chimiques ? on recense 109 éléments chimiques.
6°) Identification des éléments : compléter le
tableau
|
ce symbole
commence toujours par une majuscule, généralement on donne la première lettre
de son nom français ou latin. |
Nom de l’élément |
Symbole ( ?) |
|
Aluminium |
Al |
|
|
Argent |
Ag |
|
|
Azote (nitrogène) |
N |
|
|
Fer |
Fe |
|
|
Hydrogène |
H |
|
|
Or (aurum) |
Au |
|
|
Oxygène |
O |
|
|
Plomb |
Pb |
|
|
Sodium (natrium) |
Na |
|
|
Soufre |
S |
7°)
L’atome :
Questions série 1 : sur La structure de l’atome :
a) Nommer les deux parties (principalement ) d’un atome : les deux parties de
l’atome sont : le noyau et le nuage (ou cortège) électronique.
b) Que contient le noyau ? le noyau contient des protons et des neutrons
c) Comment est chargé électriquement le
noyau ? le noyau d’un atome est électriquement …neutre………………..
d) Que contient le nuage ou cortège
électronique et autour de quoi tourne –t –il ? le nuage contient des électrons il tourne (ou
gravite) autour du noyau.
e) Comment est chargé
ce cortège d’électrons ? le
cortège d’électrons est chargé
négativement.
f) Comment nomme t – on aussi: les protons, neutrons,
électrons ? les protons , neutrons , électrons sont appelés
« particules »…….
g) Caractéristique principale d’un atome :
à quoi est égal le nombre de protons ?
le nombre de protons est égal au nombre
d’électrons.
h ) Comment identifie t-on un atome ? (donner
un exemple)
un atome est identifié par une lettre
majuscule ( en général) à laquelle on
ajoute en haut à gauche ( identifiée par la lettre « A ») et en bas à gauche ( identifiée par la lettre
« Z ») , ce sont 2 nombres.
On donne cette convention d’écriture : ![]() A Z
Atome.
A Z
Atome.
-
Que désigne la lettre « A » ? l’ « A » est un nombre il représente
ce que l’on appelle le « nombre de masse ». , c’est la somme du
nombre de protons et du nombre de
neutrons que contient le noyau
-
Que désigne la lettre « Z » : « Z » est un nombre ; Il
représente le nombre de protons dans le noyau
( qui correspond au nombre d’électrons en
périphérie , il est appelé « numéro
atomique »
Utiliser
l’exemple pour compléter votre réponse : 1123 Na
« Na » est l’atome de
sodium ; il contient « 23
protons et neutrons » ; il possède « 11 » électrons
à sa périphérie., son nombre de masse est de « 23 ».
Comme le nombre d’électrons et égal au
nombre protons ; il y a donc 23 - 11
soit 12 neutrons dans le noyau de
sodium.
K) Que peut-on dire sur le nombre de
protons et le nombre d’électrons ?.
Dans un atome ,Il
y a autant de protons que d’électrons.
L ) Indiquer par une croix dans le tableau
l’état électrique de la particule.
|
|
Chargé positivement |
Chargée négativement |
Neutre |
|
Proton |
X |
|
|
|
Neutron |
|
|
X |
|
Electron |
|
X |
|
|
Noyau |
x |
|
|
|
Atome |
|
|
X |
M ) Choisir la bonne réponse Lbarrer
un mot.
-
le numéro atomique
d’un élément est égal à son nombre de protons (dans le noyau) , il est désigné par la lettre : Z
-
Les masses d’un proton
et d’un neutron sont à peu « prés les mêmes » . La masse d’un électron est très inférieure. Ce qui permet de penser que la masse de
l’atome est proche de celle du noyau
,
donc
de la masse de la somme des protons et
des neutrons.
-
Deux isotopes ont le même de protons ( et
par la même le même nombre d’ électrons)
(c’est à dire même numéro
atomique « Z »)
, et
ils n’ont pas le même nombre de neutrons . Des isotopes o
8°)
Les IONS
a) Comment
s’opère la liaison entre des atomes ? :
la liaison des atomes se fait « électroniquement »
b)
Compléter la phrase suivante :
Les atomes
pour s’assembler s’échangent des électrons ; on
dit en « …prenant…… » ou en « …cédant ou donnant » des électrons .
c) Comment
appelle t –on un atome qui cède ou prend (donne) des électrons ? un
atome qui cède ou prend (donne) des électrons s’appelle
un « ion »
d) Compléter les phrases suivantes :
les atomes qui cèdent ou perdent des électrons se transforment en particules
chargées …positivement , on les appelle
des « cations »……….
les atomes qui
gagnent des électrons se transforment
en particules chargées …… négativement , on les appelle des «ations »……….
………...
e) Qu’appelle
– t- on « cation » ? un atome qui cède
ou perd des électrons , il devient porteur de charge
positive , c’ est un
« cation »
Donner des exemples. H + ;
Na + ; Ca ++
f) Qu’appelle
– t - on
« Anion » ? un
atome qui gagne des électrons
est chargé
négativement , c’ est
un « ation »
Donner des exemples. Cl - ; S 2- ; O2- ;
ou des S -- ;
des O --
g)
Qu’appelle –t-on un ion
monoatomique ? un
ion monoatomique est constitué d’un seul
atome
h ) Qu’appelle
–t-on un ion
poly-atomique ? un
ion poly - atomique est constitué de plusieurs
atomes
II )
EVALUATION:
1°) Combien possède de
neutrons l’atome suivant 1123
Na :
On donne l’écriture
suivante : 1123 Na
(qui symbolise l’atome de Sodium
(natrium))
Na : désigne l’élément atome de sodium .
« 11 » : On sait que l’atome de Na a 11
électrons qui gravitent sur la périphérie du noyau .
« 23 » : représente la
somme de protons ( p
) et de neutrons ( n ) ; ainsi 23
= p + n ; puisque « p = 11 » ; 23 = p + n devient 23 = 11 + n ; on en
déduit par calcul que n = 23 –11 soit n
= 12 .
Conclusion : l’atome de sodium a 11 électrons en
périphérie ; son noyau possède 11
protons et 12 neutrons.
2°) On considère un atome de mercure (Z =
80 et A = 200) Déterminer les nombres de protons, de neutrons et
d’électrons.
« A » est un
nombre il représente ce que l’on appelle le « nombre de masse ». ,
c’est la somme du nombre de protons et du nombre de neutrons que contient le noyau et « Z » est un nombre ( de protons ou d
‘électrons) , il est appelé
« numéro atomique »
dans ce cas
il y a 80 électrons ou (et)
protons , il y a donc dans le noyau : 80 protons et ( 200 - 80)
soit 120 neutrons.
3°) Pour l’
atome d’aluminium ![]() , quel est :
, quel est :
-
le nombre de charge ? 13
-
le nombre de masse ? 27
-
le nombre de protons ? 13
-
le nombre de neutrons ? 14
-
le nombre d’électrons ? 13
4°)le
noyau d’un atome comporte 15 protons et 16 neutrons.
a)
quel est le nombre d’électrons de
cet atome ? 15
b)
Quels sont ses nombres de charge et
de masse ? 31
c)
Identifier l’atome à partir de son
numéro atomique indiqué dans le tableau ci - dessous :
|
13
Al |
14
Si |
15 P |
16 S |
17
Cl |
18 Ar |
Travaux
auto formatif N°2
I) CONTROLE:
La matière est formée de très petites particules appelées
« atomes » ; Décrire un atome et donner les noms de ses
principaux constituants : un atome est composé de deux parties principales « le noyau » et le « nuage électronique » ;
le noyau est composé de neutrons et protons.
L’élément carbone se
note ![]()
Quel est le numéro atomique de l’atome de
carbone ? « 6 »
A quoi correspondent les deux nombres 6 et 12 ? « 6 »
représente le nombre d’électrons qui est égal au nombre de protons. ;
« 12 » est le nombre (additionné) de protons et de neutrons contenu
dans le noyau.
Dessiner schématiquement l’atome d’oxygène ![]()
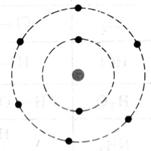
Qu’est qu’une mole d’atomes ? la « mole » est une grandeur physique , elle représente
un regroupement d’ un ensemble d’atomes. ce nombre
d’atomes est de 6 02 000 000 000 000 000 000
000 soit 6,02 ´ 10 23 atomes.
Qu ‘ appelle - t- on « nombre d’ Avogadro » ,
donnez sa valeur ? le nombre d’atomes
contenus dans une mole d’atomes s’appelle le « nombre d’
Avogadro » sa valeur et 6,02 ´
10 23 atomes.
Dans la formule du sel ( chlorure
de sodium) on a du Na+ et du
Cl - . A quoi correspondent
les écritures Na+ et Cl - ?
Na+
est du sodium ,
c’est un « cation » et Cl -
est du chlore , c’est un anion.
Comment s’exprime la masse molaire d’un atome ? la
masse molaire s’exprime en grammes par mole.
Qu’appelle - t on : masse molaire
atomique ?
La masse
molaire est la masse d’une mole d’atomes.
Que représente « aussi » le « nombre de
masse » ?
Le nombre de masse « A » représente la
masse molaire de la mole de l’atome considéré.
Combien y a t - il d’atomes d’hydrogène dans 1
g d’hydrogène. ?
Dans 1
g d’hydrogène il y a
Quelle est la masse molaire ?:
de
l’oxygène : 16 g / mol
de
l’hydrogène : 1 g / mol
, du carbone : 12 g / mol
, de l’azote :
14 g /mol
, du
chlore : 35
g / mol.
Que donne comme information le nombre d’
Avogadro ?
Le nombre d’Avogadro nous donne le nombre d’atomes contenus dans une mole d’atomes.
Répartition des électrons
( remplissage des couches) :
Les différentes
couches sont caractérisées par un nombre « n » appelé
« nombre quantique ». Chacune peut recevoir au maximum
« 2n² »électrons.
1°) Calculer les nombres d’électrons que peuvent recevoir la
couche « K » pour laquelle « n = 1 », la couche L pour
laquelle n = 2 et la couche M pour laquelle n= 3.
Nombre d’électrons contenus dans la couche
« K » :
2 fois 1 ²
= 2 électrons
2°) Les électrons remplissants les
couches successives dans l’ordre ci dessus ( n
croissant) , déterminer leur répartition dans le cas de l’atome de soufre ![]()
|
Couche |
« n » |
Nombre
d’électrons |
|
K |
1 |
2 ´ 1 ² = 2 |
|
L |
2 |
2 ´ 2 ² = 8 |
|
M |
3 |
2 ´ 3 ² =
18 |
Le nombre de charge est 16 .
L’atome de soufre possède donc 16
protons. Puisqu’il est électriquement neutre , il
possède aussi 16 électrons.
Ces électrons se répartissent de la façon suivante : 2
dans la couche K ; 8 dans la couche L et 6 dans la couche M , qui n’est pas totalement remplie.
Exercices : comparer les nombres d’électrons dans la
dernière couche occupée par le fluor ( Z = 9 ) et pour le chlore ( Z = 17).
II )EVALUATION:
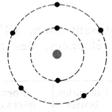
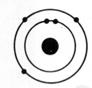
1°) Trouver, à
partir des symboles les nombres d’électrons, de protons et de neutrons contenu
dans l’ atome et en faire le modèle de Bohr:
|
|
|
1
électron ; Noyau : 1
proton ; 1 neutron |
|
|
|
8 électrons , le
Noyau : 8 proton ; 18 - 8
= 8 neutrons |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Idem : |
Donner les mêmes informations que ci dessus .Que constatez
vous ? ( ne pas faire le modèle de Bohr). |
|
|
|
|
|
|
|
|
Quelle est la structure électronique des éléments suivants :? la structure électronique est
le nuage électronique
|
Si ( Z = 14) |
« Z » = 14 protons |
|
|
S ( Z = 16) |
|
|
|
Ar ( Z = 18) |
|
|
|
Be ( Z = 4) |
|
|
En vous aidant du tableau de
classification identifier et nommer
chaque élément :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 alu
alu argon
argon arsenic
arsenic azote
azote
 carbone
carbone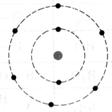
 bore
bore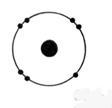 brome
brome calcium
calcium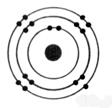 chlore
chlore